CÁNCER GÁSTRICO TEMPRANO DE TIPO INDIFERENCIADO: DISECCIÓN SUBMUCOSA ENDOSCÓPICA
Fernando Palacios S.
El tratamiento endoscópico del cáncer gástrico temprano de tipo indiferenciado no ha tenido el consenso necesario para considerarse el tratamiento estándar; sin embargo, recientes guías y estudios pueden cambiar esto. En nuestro grupo, después de casi 10 años de experiencia en disección submucosa endoscópica, y más de 200 resecciones realizadas por cáncer gástrico temprano, recién hace unos meses realizamos la primera en cáncer gástrico temprano de tipo indiferenciado. En la presente publicación les presentamos este caso y revisamos las más importantes publicaciones en relación a la evolución de la indicación de resección endoscópica en el cáncer gástrico temprano de tipo indiferenciado.
Caso clínico
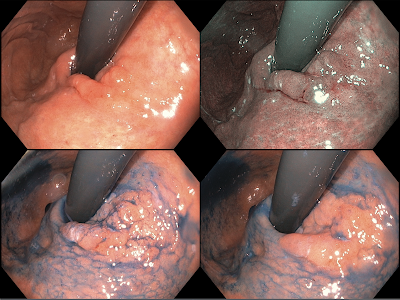
Varón de 56 años, con síntomas de reflujo, a quien se le realiza endoscopía detectando en incisura angularis de estómago, lesión deprimida de 16mm, sin úlcera, con predicción de invasión intramucosa (Fig. 1). Biopsia reveló adenocarcinoma indiferenciado subtipo anillo de sello. Tomografía de tórax y abdomen fueron negativas para metástasisganglionar o a distancia.
Con diagnóstico de Ud-EGC 0-IIc, UL0, tamaño <2cm, se indica y realiza ESD con sedoanalgesia, usando electrobisturí Dual knife de tipo regular (KD-650L), consiguiendo resección en bloque en 34 min. Espécimen extendido de 40 x 36mm. Los tiempos mas importantes de la ESD se presentan en la Fig. 2.
El análisis histopatológico describe lesión 0-IIc de 16mm, UL0, HM0, VM0, Ly0, V0, por lo que la resección endoscópica fue considerada curativa.
La endoscopía de vigilancia 6 meses después muestra área cicatricial en incisura angularis, sin evidencia de lesión residual o sincrónica (Fig 3). La tomografía de vigilancia también fue normal.
Discusión
La disección submucosa endoscópica (ESD, endoscopic submucosal dissection) se ha convertido en el tratamiento estándar del cáncer gástrico temprano (EGC, early gastric cancer) de tipo diferenciado con riesgo casi nulo de metástasis ganglionar. Sin embargo, el tratamiento endoscópico del EGC de tipo indiferenciado (Ud-EGC, undifferentiated), ha sido controversial, tanto por la menor tasa de resecciones completas y curativas, así como por los reportes de metástasis ganglionar aún en lesiones pequeñas y superficiales.
El estudio de Hirasawa et al., en especímenes quirúrgicos de gastrectomías con disección ganglionar por Ud-EGC, mostró que ninguna de 310 lesiones de cáncer indiferenciado intramucoso (pT1a), sin úlcera (UL0), tamaño <2cm y ausencia de compromiso linfovascular (Ly0, V0), se asoció con metástasis ganglionar (95% CI, 0-0.96%).1 Basado en este estudio, la más reciente guía de tratamiento de cáncer gástrico (5º edición) de la Japanese Gastric Cancer Association (JGCA), considera como indicación expandida de ESD, el Ud-EGC UL0, tamaño <2cm y clínicamente diagnosticado como intramucoso (cT1a).2 Tras la resección endoscópica en bloque y análisis patológico, cuando el Ud-EGC cumple estos criterios: pT1a, UL0, tamaño <2cm, HM0, VM0, Ly0, V0, la resección es clasificada como curabilidad endoscópica B (eCuraB). Esta guía puntualiza que el Ud-EGC con las características antes detalladas, no está incluido dentro de las indicaciones absolutas de ESD, ni en la categoría de curabilidad endoscópica A, por la falta de evidencia de resultados a largo plazo hasta el momento de publicación de la misma.
Recientemente, el estudio multicéntrico, prospectivo y confirmatorio del Japan Clinical Oncology Group (JCOG1009/1010) ha sido publicado.3 De 275 Ud-EGC con indicación expandida de ESD, 195 lograron resección curativa (71%) y en 79 la resección fue no curativa (73 recibieron gastrectomía adicional). En todo el grupo la valoración a 5 años mostró una sobrevida global de 99.3% (95% CI, 97.1-99.8%), y una sobrevida libre de recurrencia de 98.9% (95%CI, 96.5-99.6%). Es de destacar que de los 195 pacientes con resecciones curativas, ninguno tuvo en el seguimiento a 5 años, recurrencia local o a distancia, ni muertes registradas. Los excelentes resultados de este estudio en cuanto a eficacia y seguridad a largo plazo de la ESD en Ud-EGC con hasta entonces indicación expandida de ESD, ha motivado que la mas reciente guía de disección submucosa endoscópica para cáncer gástrico de la Japan Gastroenterological Endoscopy Society (2º edición),4 pase a considerar al Ud-EGD UL0, tamaño <2cm y cT1a, nueva indicación absoluta para ESD (nivel de evidencia B, grado de recomendación 1). Así mismo, si el análisis histopatológico confirma estos criterios: pT1a, UL0, tamaño <2cm, HM0, VM0, Ly0, V0, la resección es recategorizada como curabilidad endoscópica A (eCuraA). En un reciente meta-análisis en el que comparamos ESD vs cirugía incluyendo 7 estudios de cohorte y 2637 pacientes, no en contratos diferencia en la mortalidad global ajustada (aHR, 1.97; 95% CI, 0.85-4.53).5
Conclusión y recomendaciones
Creemos que recientes estudios y guías sustentan la indicación de ESD en Ud-EGC con características específicas y es muy probable que se constituya en su terapia estándar. Sin embargo, es muy importante el diagnóstico preciso en la evaluación preoperatoria, para satisfacer con claridad y sin dudas los criterios que sustentan la indicación de ESD. Además la ESD debe ser realizada teniendo ya experiencia avanzada con la técnica, se sugieren más de 50 ESD previas. El análisis histopatológico debe ser preciso, con cortes del espécimen cada 2mm para estar seguro de los detalles de invasión en profundidad y excluir compromiso linfovascular. Finalmente, la vigilancia cada 6 meses con endoscopía y tomografía son muy importantes.
Bibliografía
1. Hirasawa T, Gotoda T, Miyata S, et al. Incidence of lymph node metastasis and the feasibility of endoscopic resection for undifferentiated-type early gastric cancer. Gastric Cancer 2009;12:148-152
2. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer 2021;24:1-21
3. Takizawa K, Ono H, Hasuike N, et al. A nonrandomized, single-arm confirmatory trial of expanded endoscopic submucosal dissection indication for undifferentiated early gastric cancer: Japan Clinical Oncology Group study (JCOG1009/1010). Gastric cancer 2021;24:479-491
4. Ono H, Yao K, Fujishiro M, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer (second edition). Digestive Endoscopy 2021;33:4-20
5. Benites H, Palacios F, Carlin A, et al. Endoscopic submucosal dissection versus surgery for patients with undifferentiated early gastric cancer. Rev Esp Enferm Dig 2022. doi: 10.17235/reed.2022.8564/2021.