La fuga postoperia en el tracto gastrointestinal es una complicación que acarrea una elevada mortalidad, que puede ir del 12 al 50%.(1 – 4) En las últimas décadas, diversas opciones de tratamiento endoscópico han sido reportadas con altas tasas de éxito para el manejo de dicha condición, éstas incluyen las técnicas de cierre con clips (convencionales u OVESCO), sutura endoscópica, pegamentos tisulares, derivación mediante prótesis metálica autoexpandible (SEMS, de self expandable metal stent), drenaje endoscópico interno con catéteres tipo doble pigtail, septotomía, y el método E-VAC (Endoscopic vacuum-assisted closure).
Actualmente no existe consenso sobre el manejo de elección, es por ello que en la práctica clínica se opta por un abordaje individualizado en función del caso así como de la experiencia y disponibilidad de recursos. Presentamos un caso de fuga en anastomosis esófago-yeyunal resuelto mediante colocación de SEMS.
Caso clínico
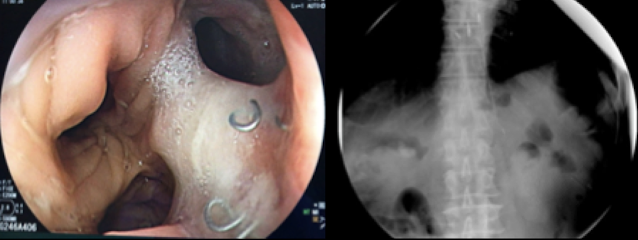
Varón de 83 años, con antecedente de hipotiroidismo subclínico, diagnosticado de cáncer gástrico, fue sometido a una gastrectomía total D2 + anastomosis esófago-yeyunal en Y de Roux. Posterior a la cirugía cursó de forma persistente con dolor abdominal a nivel de herida operatoria, sin evidenciar signos de flogosis, así como drenaje turbio a través de dren laminar derecho.
Los exámenes de laboratorio mostraron leucocitosis inicial y permanente elevación de la PCR: leucocitos 13.99K/ul, hemoglobina 12.5g/dl, albúmina 3.66g/dl y PCR de 12.2 a 25.3mg/dl.
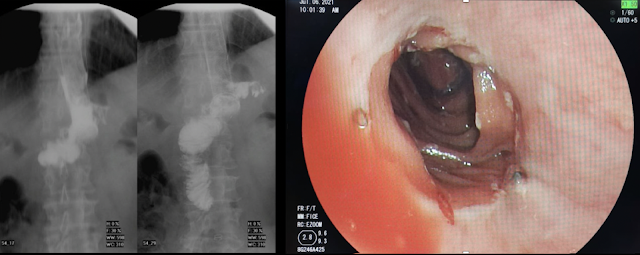
Se decidió iniciar cobertura antibiótica con piperacilina/tazobactam, NPT y solicitar exámenes de imagen. La tomografía reveló falta de continuidad y afrontamiento de anastomosis esófago-yeyunal con separación de suturas metálicas, asociado a pequeñas colecciones adyacentes con contenido aéreo y, el tránsito intestinal mostró fuga de contraste hacia hipocondrio derecho con trayecto de salida hacia dren y bolsa colectora.
Discusión
La dehiscencia y fuga anastomótica posterior a una gastrectomía total se presentan con una frecuencia de 3 a 12%,(5) con mayor incidencia de lo que se reporta para bypass gástrico en Y de Roux y manga gástrica.
En un reciente estudio,(4) que evaluó de forma retrospectiva la efectividad del tratamiento endoscópico de las fugas anastomóticas del tracto gastrointestinal superior en 206 pacientes de 10 centros de referencia, se observó un éxito clínico general y resolución de la fuga de 80.1 y 83.5%, repectivamente, con un porcentaje de resolución individual para el SEMS de 44.6%, manteniédolo in situ por un promedio de 35 días (RIQ 21 – 50 días).
Otros estudios muestran tasas más altas de éxito clínico para el SEMS en el manejo de fuga anastomótica, que van del 60.5 al 90%.(6 – 8) Si bien se ha descrito una proporción considerable de complicaciones asociadas, éstas suelen no ser graves o ser, en su mayoría, tributarias de manejo endoscópico, con un porcentaje de perforación de hasta 2%.(4, 8)
En cuanto a la migración, se han documentado tasas de entre 8.5 y 21.7%,(4, 8, 9) siendo menor en aquellos estudios en los cuales se colocaron mayormente SEMS parcialmente cubiertos(8) o en aquellos en los que se utilizaron hemoclips como mecanismo de fijación.(9)
Se han evaluado, además, múltiples factores asociados al éxito o falla de la terapia con SEMS para esta condición. Persson et al.(10), identificaron como factores de riesgo para falta de respuesta a la fuga persistente luego de la colocación del primer SEMS, formación de fístula traqueoesofágica, así como la reducida capacidad física del paciente antes de la cirugía. Por otro lado, se ha visto mejor respuesta en aquellos pacientes sometidos a gastrectomía total (en comparación con esofaguectomía y cirugía bariátrica), en mejores condiciones clínicas, con inicio más temprano del tratamiento y menor diámetro del defecto.(1, 4, 11)
En el caso presentado se pueden reconocer los factores descritos como predictores del buen resultado obtenido, ya que se trataba de un paciente operado de gastrectomía total, clínicamente estable (y con adecuados parámetros nutricionales), a quien se colocó el SEMS de forma temprana (PO15) para sellar un defecto menor de 20 mm, siendo ésta medida un punto de corte sugerido en el estudio de Rodrigues-Pinto et al.(11)
Finalmente, si bien aun es debatible la alternativa más adecuada para el manejo de fugas anastomóticas, la elevada morbimortalidad de una reintervención quirúrgica así como la evidencia actual apuntan a considerar al manejo endoscópico como terapia de primera línea. Es por ello que este caso aporta a la experiencia nacional, demostrando el éxito de un abordaje poco invasivo y con herramientas accesibles.
Dra. Fiorella Monge, Dra. Irene Cárdenas y Dr. Luis A. Cervera
Departamento del Aparato Digestivo.
Hospital Edgardo Rebagliati Martins.
Bibliografía:
- El Hajj II, Imperiale TF, Rex DK, et al. Treatment of esophageal leaks, fistulae, and perforations with temporary stents: evaluation of efficacy, adverse events, and factors associated with successful outcomes. Gastrointest Endosc 2014;79:589-598.
- Swinnen J, Eisendrath P, Rigaux J, et al. Self-expandable metal stents for the treatment of benign upper GI leaks and perforations. Gastrointest Endosc 2011;73:890-899.
- Van Boeckel PG, Dua KS, Weusten BL, et al. Fully covered self-expandable metal stents (SEMS), partially covered SEMS and self-expandable plastic stents for the treatment of benign esophageal ruptures and anastomotic leaks. BMC Gastroenterol 2012;12:19.
- Rodrigues-Pinto E, Pereira P, Sousa-Pinto B, Shehab H, Pinho R, Larsen MC, Irani S, Kozarek RA, Capogreco A, Repici A, Shemmeri E, Louie BE, Rogalski P, Baniukiewicz A, Dabrowski A, Correia de Sousa J, Barrias S, Ichkhanian Y, Kumbhari V, Khashab MA, Bowers N, Schulman AR, Macedo G, Retrospective multicenter study on endoscopic treatment of upper gastrointestinal postsurgical leaks, Gastrointestinal Endoscopy (2020).
- Lang H, Piso P, Stukenborg C, et al. Management and results of proximal anastomotic leak in a series of 1114 total gastrectomies for gastric carcinoma. Eur J Surg Oncol 2000;26:168–71.
- Fernandez A, Gonzalez-Carrera V, Gonzalez- Portela C, Carmona A, de-la-Iglesia M, Vazquez S: Fully covered metal stents for the treatment of leaks after gastric and esophageal surgery. Rev Esp Enferm Dig 2015;107:608– 613.
- Aryaie AH, Singer JL, Fayezizadeh M, Lash J, Marks JM: Efficacy of endoscopic manage- ment of leak after foregut surgery with endo- scopic covered self-expanding metal stents (SEMS). Surg Endosc 2017;31:612–617.
- Anderloni A, Genco C, Massidda M, Di Leo M, Fumagalli UR, Rosati R, Correale L, Maselli R, Ferrara EC, Jovani M, Repici A. Self-Expanding Metal Stents for the Treatment of Post-Surgical Esophageal Leaks: A Tertiary Referral Center Experience. Dig Surg. 2019;36(4):309-316.
- John A, Chowdhury SD, Kurien RT, David D, Dutta AK, Simon EG, Abraham V, Joseph AJ, Samarasam I. Self-expanding metal stent in esophageal perforations and anastomotic leaks. Indian J Gastroenterol. 2020 Oct;39(5):445-449.
- Persson S, Rouvelas I, Kumagai K, et al. Treatment of esophageal anastomotic leakage with self-expanding metal stents: analysis of risk factors for treatment failure. Endosc Int Open. 2016;4(4):E420-E426.
- Rodrigues-Pinto Eduardo, Pereira Pedro, Ribeiro Armando, Moutinho-Ribeiro Pedro, Lopes Susana, Macedo Guilherme. Self-expanding metal stents in postoperative esophageal leaks. Rev. esp. enferm. dig. [Internet]. 2016 Mar [citado 2021 Jul 09]; 108( 3 ): 133-137.