RESECCIÓN ENDOSCÓPICA DE CÁNCER TEMPRANO DE LA UNIÓN GASTRO-ESOFÁGICA ASOCIADO A BARRETT
Fernando Palacios S.
La incidencia de adenocarcinoma de esófago asociado a Barrett está incrementando, por lo que la vigilancia y detección temprana son importantes para ofertar terapias curativas mínimamente invasivas y de baja morbilidad. Les presentamos dos casos de cáncer temprano de la unión gastro-esofágica (UGE) asociados a Barrett, tratados exitosamente mediante resección endoscópica, y revisamos las principales guías y sus recomendaciones al respecto.
Casos clínicos
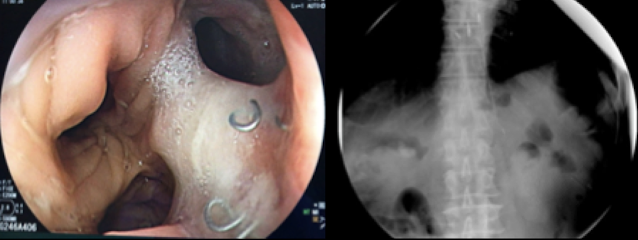
Caso 1. Varón de 69 años, con sobrepeso, hipertensión arterial y enfermedad de reflujo gastroesofágico de larga data, a quien se le detecta a nivel de la UGE, en la base de una lengüeta de 15mm de mucosa columnar, lesión 0-IIa de 10mm, cuya biopsia revela adenocarcinoma diferenciado. Considerando que la lesión era intramucosa y pequeña, decidimos resecarla mediante mucosectomía asistida con banda (B-EMR); la lesión salió en un pedazo y la lengüeta de mucosa columnar remanente en otro. La patología mostró adenocarcinoma diferenciado intramucoso con márgenes libres en primer pedazo, y Barrett con displasia de bajo grado en el segundo pedazo. La resección fue considerada completa y curativa.
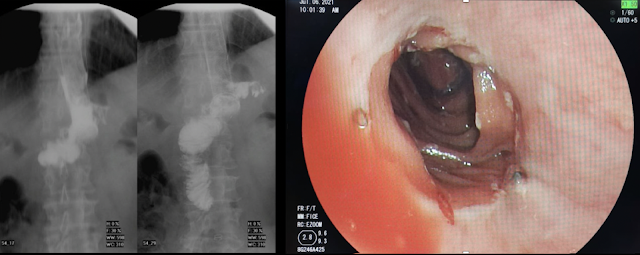
Caso 2. Mujer de 56 años, con enfermedad de reflujo de larga data, con lesión 0-IIb de 8mm a nivel del cardias, la cual es muy discretamente rojiza con luz blanca, con NBI se reconoce microestructura irregular, y con cromoendoscopía con ácido acético e índigo carmín, resalta su demarcación. La lesión se reseca en bloque mediante B-EMR. La patología revela adenocarcinoma intramucoso (invade lámina propia), con márgenes libres y sin invasión linfovascular. La resección fue considerada completa y curativa.
Discusión
Dada la mayor incidencia de enfermedad de reflujo gastroesofágico y esófago de Barrett, los programas de vigilancia permiten la detección temprana de lesiones superficiales, lo que permite su tratamiento mediante resección endoscópica. Las técnicas de resección usadas son la mucosectomía (EMR) y la disección submucosa endoscópica (ESD), las cuales se indican y consideran curativas en adenocarcinoma temprano de esófago intramucoso independientemente del tamaño, pudiendo extenderse el criterio curativo a las lesiones que invaden superficialmente la submucosa (<500um) y que miden <3cm, en ausencia de invasión linfovascular.
En Japón, la técnica de resección endoscópica recomendada es la ESD, por sus tasas más altas de resección en bloc y completa, especímenes más grandes que permiten mejor análisis histológico, y menor tasa de recurrencias, en comparación a la EMR, como se muestra en los resultados de la revisión sistemática realizada por la JGES (Japan Gastroenterological Endoscopy Society) en su mas reciente guía de resección endoscópica para cáncer esofágico. (1,2)
EMR | ESD | |
en bloc (%) | 50 | 96.4 |
R0 (%) | 39.7 | 81.9 |
Curative (%) | ? | ? |
Recurrence (%) | 12.4 | 2.5 |
- Ishihara R, Arima M, Lizuka T, et al (JGES). Endoscopic submucosal dissection/endoscopic mucosal resection guidelines for esophageal cancer. Dig Endoscopic 2020;32:452-493
- Ishihara R, Goda K and Oyama T.Endoscopic diagnosis and treatment of esophageal adenocarcinoma: introduction of Japan Esophageal Society classification of Barrett´s esophagus. J Gastroenterol 2019;54:1-9
- Sharma P, Shaheen N, Katzka D, et al. AGA clinical practice update on endoscopic treatment of Barrett´s esophagus with dysplasia and/or early cancer: Expert Review. Gastroenterol 2020;158:760-769
- Pimentel-Nunes P, Libanio D, Bastiaansen B, et al. Endoscopic submucosal dissection for superficial gastrointestinal lesions: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2022. Endoscopy 2022; doi.org/10.1055/a-1811-7025
- Han C, Sun Y. Efficacy and safety of endoscopic submucosal dissection versus endoscopic mucosal resection for superficial esophageal carcinoma: a systematic review and meta-analysis. Dis Esophag 2020;00:1-14
- Terheggen G, Horn E-M, Vieth M, et al. A randomised trial of endoscopic submucosal dissection versus endoscopic mucosal resection for early Barrett´s neoplasia. Gut 2017;66:783-793