•
Las
enfermedades digestivas representan la cuarta causa de atenciones ambulatorias
en los centros de salud peruanos, siendo la gastritis y las úlceras pépticas
las más frecuentes, representando un tercio del total de atenciones gastroenterológicas
del país (1). La infección por H. pylori es un factor importante en la génesis
de la gastritis, úlcera péptica y del cáncer de estómago, siendo el cáncer
gástrico la octava causa de mortalidad en el país, con una tasa de 17.1 por
100,000 habitantes (2).
• Según el estudio clásico realizado por el Dr. Ramírez Ramos, que ha sido referencia para todos nosotros, efectuado en Lima publicado en el 2003, la prevalencia de la infección por H. pylori en los pacientes en quienes se realizó endoscopia alta había disminuido, de 83.3% en 1985 a 58.7% en el 2002 (3). Luego de este estudio se han publicado varios estudios sobre prevalencia en estudios endoscópicos los cuáles muestran una heterogeneidad de resultados.
•
Como
podemos ver la prevalencia de la infección por Helicobacter pylori se
distribuye a manera de mosaico, varía mucho dependiendo de la localización del
estudio, inclusive; como se puede demostrar en la ciudad de Lima; dentro de una misma ciudad encontramos
diferentes tasas. Muchos factores influyen en esta heterogeneidad como el nivel
socioeconómico y el acceso a servicios básicos.
•
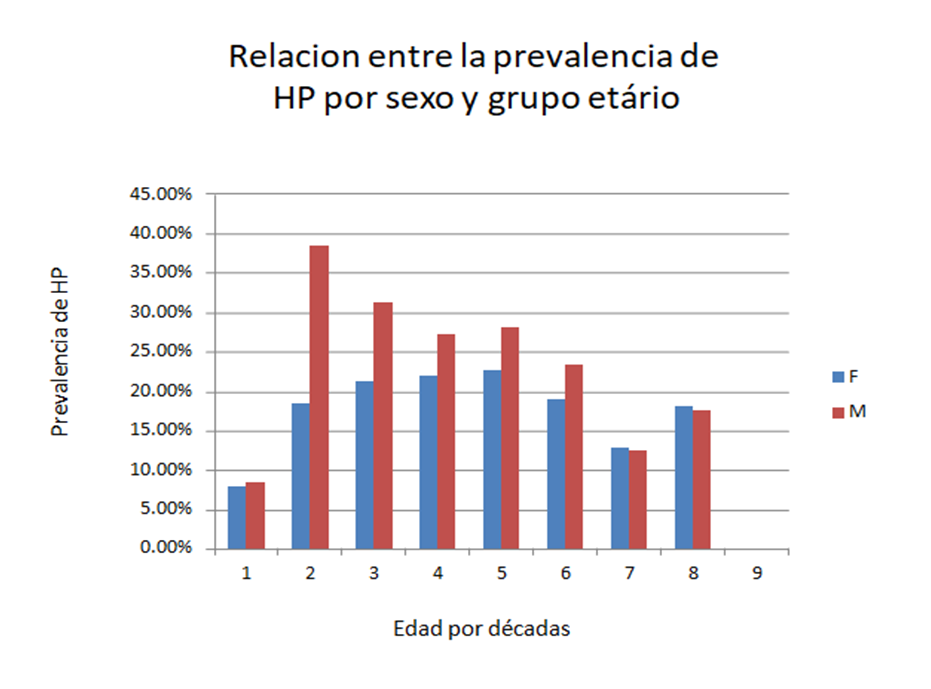
Otros
factores que afectan la prevalencia son la edad y el sexo. En Clínica Delgado
realizamos un estudio donde revisamos los datos de 2538 endoscopias realizadas
por dispepsia en el año 2019 y encontramos una prevalencia de 23.2% de
infección por Helicobacter pylori. En
este estudio encontramos que la mayor prevalencia se encontraba en varones
jóvenes (4).
Como vemos la prevalencia por Helicobacter pylori varía mucho dentro del Perú, por lo que cada centro asistencial debería levantar su estadística, compartirla y así podríamos tener una idea más exacta del impacto de esta infección.
Dr. Max Yoza
Bibliografia:
Datos de la tabla 1
Prochazka
Zárate R, Salazar Muente FA, Barriga Calle E, Salazar Cabrera F. Prevalencia de
Helicobacter pylori en una clínica privada de Lima: sensibilidad de las
biopsias del antro y el cuerpo, y la prueba rápida de la ureasa. Revista de
Gastroenterología del Perú. 2010 Jan;30(1):33–9.
http://www.revistagastroperu.com/index.php/rgp/article/view/376
Ayala Rios
S, Pichilingue Prieto O, Capcha Loyola T, Alba Rodriguez ME, Pichilingue Reto
C. Dispepsia: características clínicas, hallazgos endoscópicos e histológicos
en pacientes atendidos en el Hospital Nacional Hipólito Unanue, Lima, Perú,
durante el año 2010. Revista de Gastroenterología del Perú. 2013
Jan;33(1):28–33.
https://www.revistagastroperu.com/index.php/rgp/article/view/228
Manrique-Lemus
MN, Rojas-Vilca JL, Soriano-Álvarez C, Palomino-Portilla E. Helicobacter pylori
y lesiones gástricas premalignas en pacientes con dispepsia no investigada en
un hospital general de Lima. Revista de la Sociedad Peruana de Medicina
Interna. 2018;31(4):128–36.
https://revistamedicinainterna.net/index.php/spmi/article/view/3
Bilgilier
C, Thannesberger J, Ojeda Cisneros M, Boehnke K, Wu J, Xi C, et al.
Antimicrobial Resistance of Helicobacter pylori in Gastric Biopsy Samples from
Lima/Peru. Microb Drug Resist. 2020 Oct 20;
https://pubmed.ncbi.nlm.nih.gov/33085931/
Aliaga Ramos
J, Cedrón Cheng H, Pinto Valdivia J. Comparación de prevalencia de infección
por Helicobacter pylori en pacientes con dispepsia entre dos instituciones de
diferentes estratos socioeconómicos en el periodo 2017-2018. Revista de
Gastroenterología del Perú. 2019 Jul;39(3):211–4.
http://www.scielo.org.pe/scielo.php?pid=S1022-51292019000300002&script=sci_arttext
Yoza M, Carrasco R, Li B, Bustios C, Contardo C, Palacios F, Miyagui J, Niebuhr J, Canales O, Monge V. Características de la infección de Helicobacter pylori en un hospital privado de Lima, experiencia del 2019 y revisión de la literatura. Revista de Gastroenterología del Perú. 2022 Mar 31;42(1):7–12.
http://www.revistagastroperu.com/index.php/rgp/article/view/1339