Blog destinado a la educación de médicos gastroenterólogos y afines. Tres Generaciones de profesores con ganas de seguir enseñando.
Temas por Etiquetas
Etiquetas por temas. Presionar al etiqueta para redirigirse
- ESD (7)
- cáncer gástrico temprano (5)
- SEMS (4)
- resección endoscópica (4)
- Cáncer páncreas (3)
- EGC (3)
- EMR (3)
- Acalasia (2)
- Endoscopia (2)
- Helicobacter pylori (2)
- NBI (2)
- POEM (2)
- gastritis (2)
- indiferenciado (2)
- Aerosoles (1)
- Anatomia (1)
- Barrett (1)
- Canal anal (1)
- Covid (1)
- ERCP (1)
- IT Knife (1)
- Lesión subepitelial gástrica (1)
- SARS (1)
- SARS-COv-2 (1)
- STER (1)
- Sala de endoscopia (1)
- Spray (1)
- TNE (1)
- TNE gástrico (1)
- Tumor de páncreas (1)
- USE (1)
- Unión gastroesofágica (1)
- Z POEM (1)
- Zenker (1)
- adenoma colon (1)
- cancer gastrico temprano (1)
- cancer temprano UEG (1)
- caracterización (1)
- cardias (1)
- cianoacrilato (1)
- cirugía funcional (1)
- colecistitis (1)
- cromoendoscopía (1)
- cáncer colorectal temprano (1)
- cáncer de colon (1)
- cáncer temprano esófago (1)
- células en anillo de sello (1)
- disección submucosa (1)
- ecoendoscopia (1)
- ecoendoscopía (1)
- fuga anastomosis (1)
- fístula anastomosis (1)
- linfoma gástrico (1)
- lipoma (1)
- magnificación (1)
- manometría (1)
- miotomia Heller (1)
- neurólisis (1)
- plexo celiaco (1)
- propofol (1)
- prótesis (1)
- pólipos gástricos (1)
- recto (1)
- recurrencia (1)
- sangrado (1)
- sedación (1)
- stent duodenal (1)
- stent esofágico (1)
- tumor sólido seudopapilar (1)
- vasos en empalizada (1)
- várices duodenales (1)
- úlcera (1)
sábado, 24 de junio de 2023
Base de artículos sobre prótesis gastroduodenal
viernes, 23 de junio de 2023
Base de artículos sobre sedación en endoscopia
jueves, 19 de enero de 2023
ACALASIA: ¿Qué hacer cuando falla la miotomía de Heller laparoscópica?
Fernando Palacios S.
La miotomía de Heller laparoscópica (LHM, laparoscopic Heller myotomy) es el tratamiento estándar de la acalasia en muchos centros; sin embargo, 10-20% de pacientes presentan síntomas persistentes o recurrentes, mayormente debido a miotomía incompleta del esfínter esofágico inferior (EEI), y en menor medida a una fundoplicatura muy ajustada o a estenosis péptica.
Presentamos el caso de un paciente con acalasia de larga data, con síntomas persistentes e pesar de LHM décadas atrás, resueltas mediante miotomía endoscópica peroral (POEM) de rescate. Revisamos las opciones de tratamiento en estos casos.
Caso clínico
Varón de 45 años, con acalasia diagnosticada a los 10 años de edad, tratada con LHM y fundoplicatura.
Por mas de 30 años ha sentido disfagia leve, llenura retroesternal y regurgitación postural; sin embargo, su peso y condición física general se mantuvieron buenos.
Endoscopía actual y esofagograma con bario cronometrado con incidencia al minuto 5, muestran esófago severamente dilatado (diámetro transverso mayor de 8cm), sigmoideo, con abundante contenido alimentario y columna de bario de 25cm.
Además por endoscopía se evalúa en detalle esófago distal, determinando EEI residual de 1cm en su extremo superior, con “signo de roseta”; sin embargo, 2.5cm distales entreabren a la insuflación por miotomía pasada. Además en retroflexión signos de fundoplicatura laxa.
Definimos el problema como acalasia refractaria por LHM incompleta, y decidimos hacer POEM de rescate.
Se realiza POEM con Gold knife tipo “T” de 4mm, acceso posterior, con marcada dificultad en la generación del acceso mucoso y túnel submucoso, por engrosamiento mucoso significativo y fibrosis submucosa moderada; se consigue extender túnel submucoso hasta la altura de segunda arteria penetrante del lado gástrico. Realizamos miotomía selectiva de la circular interna en todo el trayecto.
Paciente salió de alta un día después de POEM, con progresión gradual de dieta, y casi dos meses después no presenta molestias digestivas, Eckardt “0” puntos; tampoco síntomas de reflujo.
Discusión
10 a 20% de pacientes con acalasia tratados con LHM presentan síntomas persistentes o recurrentes, generalmente debido a miotomía incompleta del EEI. En estos casos se plantean tres opciones de tratamiento: 1) dilatación con balón, que suele dar alivio transitorio; 2) nueva LHM, que suele ser técnicamente difícil, pues hay que primero liberar adherencias y la fundoplicatura, y luego realizar nueva miotomía y fundoplicatura; y 3) POEM, que nos permite una miotomía mas larga, con fácil acceso a la porción del EEI residual post Heller, que suele estar en su extremo superior, pudiendo acceder posteriormente, opuestos a sitio de LHM; por otro lado contamos con la fundoplicatura quirúrgica pasada que previene el reflujo.1,2
En un estudio multicéntrico prospectivo, Tyberg A. et al, evaluaron la eficacia del POEM post LHM en 51 pacientes con acalasia y molestias persistentes o recurrentes. Se consiguió éxito técnico en 100% de casos y éxito clínico en 94%, este último definido por una puntuación de Eckardt <3, con seguimiento promedio de 24 meses. Muy interesantemente, 15 pacientes (29%) tuvieron enfermedad de larga data y esófago sigmoideo previo al POEM de rescate, e incluso ellos tuvieron respuesta favorable.3
Una reciente revisión sitemática y meta-análisis de POEM en pacientes con miotomía de Heller previa, reclutó 9 estudios y 272 pacientes con acalasia, determinando éxito técnico del POEM en 99.3% y éxito clínico en 90% (95% CI, 83.1%-96.8%).4
Conclusión y recomendaciones
El POEM es posible de realizar, seguro y eficaz en pacientes con acalasia refractaria o recurrente y con miotomía de heller previa. Posiblemente sea el tratamiento ideal en este tipo de pacientes. A pesar de ser considerado un escenario de POEM difícil, en los pacientes que hemos tratado como grupo no hemos encontrado una dificultad significativa. En el presente caso, la complejida especial deriva de larga evolución, engrosamiento de la mucosa y desarrollo de megaesófago sigmoideo.
Bilbliografía
lunes, 12 de diciembre de 2022
Prevalencia de la infección por Helicobacter pylori en estudios endoscópicos en el Perú
•
Las
enfermedades digestivas representan la cuarta causa de atenciones ambulatorias
en los centros de salud peruanos, siendo la gastritis y las úlceras pépticas
las más frecuentes, representando un tercio del total de atenciones gastroenterológicas
del país (1). La infección por H. pylori es un factor importante en la génesis
de la gastritis, úlcera péptica y del cáncer de estómago, siendo el cáncer
gástrico la octava causa de mortalidad en el país, con una tasa de 17.1 por
100,000 habitantes (2).
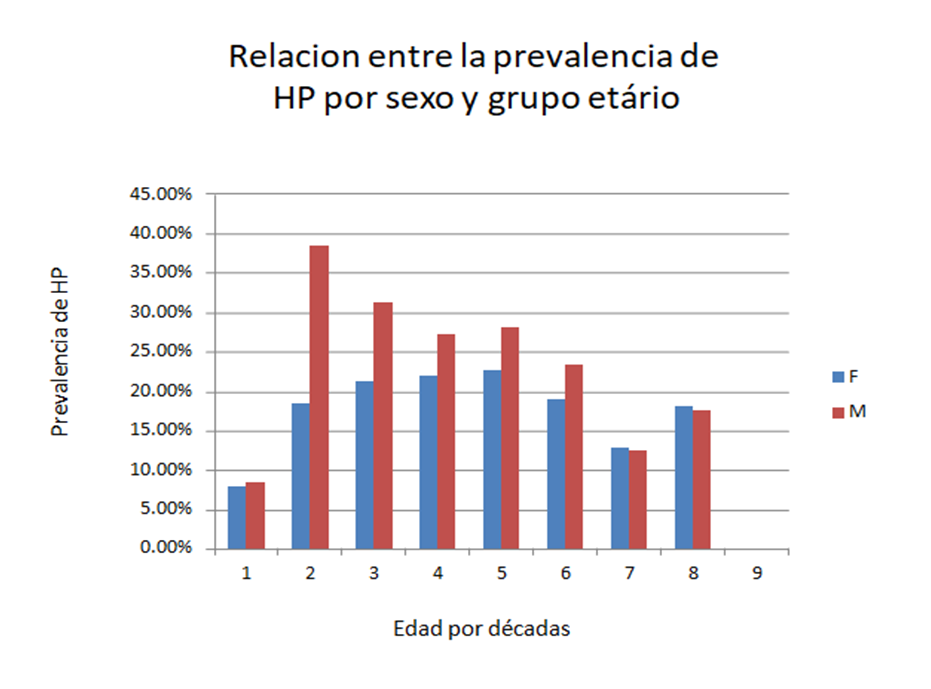
• Según el estudio clásico realizado por el Dr. Ramírez Ramos, que ha sido referencia para todos nosotros, efectuado en Lima publicado en el 2003, la prevalencia de la infección por H. pylori en los pacientes en quienes se realizó endoscopia alta había disminuido, de 83.3% en 1985 a 58.7% en el 2002 (3). Luego de este estudio se han publicado varios estudios sobre prevalencia en estudios endoscópicos los cuáles muestran una heterogeneidad de resultados.
•
Como
podemos ver la prevalencia de la infección por Helicobacter pylori se
distribuye a manera de mosaico, varía mucho dependiendo de la localización del
estudio, inclusive; como se puede demostrar en la ciudad de Lima; dentro de una misma ciudad encontramos
diferentes tasas. Muchos factores influyen en esta heterogeneidad como el nivel
socioeconómico y el acceso a servicios básicos.
•
Otros
factores que afectan la prevalencia son la edad y el sexo. En Clínica Delgado
realizamos un estudio donde revisamos los datos de 2538 endoscopias realizadas
por dispepsia en el año 2019 y encontramos una prevalencia de 23.2% de
infección por Helicobacter pylori. En
este estudio encontramos que la mayor prevalencia se encontraba en varones
jóvenes (4).
Como vemos la prevalencia por Helicobacter pylori varía mucho dentro del Perú, por lo que cada centro asistencial debería levantar su estadística, compartirla y así podríamos tener una idea más exacta del impacto de esta infección.
Dr. Max Yoza
Bibliografia:
Datos de la tabla 1
Prochazka
Zárate R, Salazar Muente FA, Barriga Calle E, Salazar Cabrera F. Prevalencia de
Helicobacter pylori en una clínica privada de Lima: sensibilidad de las
biopsias del antro y el cuerpo, y la prueba rápida de la ureasa. Revista de
Gastroenterología del Perú. 2010 Jan;30(1):33–9.
http://www.revistagastroperu.com/index.php/rgp/article/view/376
Ayala Rios
S, Pichilingue Prieto O, Capcha Loyola T, Alba Rodriguez ME, Pichilingue Reto
C. Dispepsia: características clínicas, hallazgos endoscópicos e histológicos
en pacientes atendidos en el Hospital Nacional Hipólito Unanue, Lima, Perú,
durante el año 2010. Revista de Gastroenterología del Perú. 2013
Jan;33(1):28–33.
https://www.revistagastroperu.com/index.php/rgp/article/view/228
Manrique-Lemus
MN, Rojas-Vilca JL, Soriano-Álvarez C, Palomino-Portilla E. Helicobacter pylori
y lesiones gástricas premalignas en pacientes con dispepsia no investigada en
un hospital general de Lima. Revista de la Sociedad Peruana de Medicina
Interna. 2018;31(4):128–36.
https://revistamedicinainterna.net/index.php/spmi/article/view/3
Bilgilier
C, Thannesberger J, Ojeda Cisneros M, Boehnke K, Wu J, Xi C, et al.
Antimicrobial Resistance of Helicobacter pylori in Gastric Biopsy Samples from
Lima/Peru. Microb Drug Resist. 2020 Oct 20;
https://pubmed.ncbi.nlm.nih.gov/33085931/
Aliaga Ramos
J, Cedrón Cheng H, Pinto Valdivia J. Comparación de prevalencia de infección
por Helicobacter pylori en pacientes con dispepsia entre dos instituciones de
diferentes estratos socioeconómicos en el periodo 2017-2018. Revista de
Gastroenterología del Perú. 2019 Jul;39(3):211–4.
http://www.scielo.org.pe/scielo.php?pid=S1022-51292019000300002&script=sci_arttext
Yoza M, Carrasco R, Li B, Bustios C, Contardo C, Palacios F, Miyagui J, Niebuhr J, Canales O, Monge V. Características de la infección de Helicobacter pylori en un hospital privado de Lima, experiencia del 2019 y revisión de la literatura. Revista de Gastroenterología del Perú. 2022 Mar 31;42(1):7–12.
http://www.revistagastroperu.com/index.php/rgp/article/view/1339
sábado, 3 de septiembre de 2022
ESD gástrica desafiante: túnel submucoso desde esófago al rescate
Consejos en resección endoscópica
La disección submucosa de estómago es de mayor dificultad en su tercio superior. Cómo afrontar estas lesiones sin disponer de endoscopios "Multi bending" constituye un desafío. Presentamos un caso con esta localización y planteamos consejos para su resolución.
Mujer de 76 años con dispepsia. No. antecedentes de importancia; es Testigo de Jehová. En endoscopía alta se identificó lesión 0-IIa subcardial de 35 x 30mm, en curvatura menor, con biopsia que revela adenocarcinoma bien diferenciado.
Por endoscopía la predicción de invasión fue de cáncer intramucoso. La tomografía de tórax y abdomen fue normal. Se considera que tiene indicación para disección submucosa endoscópica, pero tiene dos problemas importantes: 1) difícil afrontamiento de lesión, en retroflexión no se alcanza el extremo superior de la lesión que se extiende hasta cardias, y mayor parte se afronta perpendicularmente; 2) área muy vascularizada y con riesgo de sangrado mayor, pero paciente por su religión no acepta transfusiones de sangre.
Nuestra estrategia fue enfrentar esta lesión mediante un túnel submucoso iniciado en esófago distal, técnica similar al POEM, con dos objetivos:
1) disecar toda la submucosa por debajo de lesión, teniendo estabilidad de gastroscopio y mejor maniobrabilidad
2) Acceso mucoso en esófago que es poco vacularizado, túnel submucoso transcardial que permite identificación y termocoagulación de vasos de grueso calibre (es clave la identificación de las fibras musculares oblícuas internas)
Finalmente, debajo de lesión, el túnel submucoso lo convertimos en bolsillo, hasta asegurarnos que la disección submucosa involucró toda la lesión, para recién entonces realizar la incisión mucosa circunferencial, habiendo asegurado la termocoagulación de todos los vasos de la submucosa previamente.
Conseguimos así finalizar esta disección submucosa endoscópica desafiante, con resección en bloque y sin sangrado, en 98 minutos.
Consejos:
1) las lesiones cordiales y subcardiales de curvatura menor (parcialmente ambas paredes; no aplica para curvatura mayor) pueden afrontarse mediante túnel submucoso desde esófago con mejor maniobrabilidad.
2) la técnica de túnel submucoso y bolsillo permite una mejor identificación de los vasos submucosos y su tratamiento para prevenir hemorragia.
sábado, 25 de junio de 2022
RESECCIÓN ENDOSCÓPICA DE CÁNCER TEMPRANO DE LA UNIÓN GASTRO-ESOFÁGICA ASOCIADO A BARRETT
RESECCIÓN ENDOSCÓPICA DE CÁNCER TEMPRANO DE LA UNIÓN GASTRO-ESOFÁGICA ASOCIADO A BARRETT
Fernando Palacios S.
La incidencia de adenocarcinoma de esófago asociado a Barrett está incrementando, por lo que la vigilancia y detección temprana son importantes para ofertar terapias curativas mínimamente invasivas y de baja morbilidad. Les presentamos dos casos de cáncer temprano de la unión gastro-esofágica (UGE) asociados a Barrett, tratados exitosamente mediante resección endoscópica, y revisamos las principales guías y sus recomendaciones al respecto.
Casos clínicos
Caso 1. Varón de 69 años, con sobrepeso, hipertensión arterial y enfermedad de reflujo gastroesofágico de larga data, a quien se le detecta a nivel de la UGE, en la base de una lengüeta de 15mm de mucosa columnar, lesión 0-IIa de 10mm, cuya biopsia revela adenocarcinoma diferenciado. Considerando que la lesión era intramucosa y pequeña, decidimos resecarla mediante mucosectomía asistida con banda (B-EMR); la lesión salió en un pedazo y la lengüeta de mucosa columnar remanente en otro. La patología mostró adenocarcinoma diferenciado intramucoso con márgenes libres en primer pedazo, y Barrett con displasia de bajo grado en el segundo pedazo. La resección fue considerada completa y curativa.
Caso 2. Mujer de 56 años, con enfermedad de reflujo de larga data, con lesión 0-IIb de 8mm a nivel del cardias, la cual es muy discretamente rojiza con luz blanca, con NBI se reconoce microestructura irregular, y con cromoendoscopía con ácido acético e índigo carmín, resalta su demarcación. La lesión se reseca en bloque mediante B-EMR. La patología revela adenocarcinoma intramucoso (invade lámina propia), con márgenes libres y sin invasión linfovascular. La resección fue considerada completa y curativa.
Discusión
Dada la mayor incidencia de enfermedad de reflujo gastroesofágico y esófago de Barrett, los programas de vigilancia permiten la detección temprana de lesiones superficiales, lo que permite su tratamiento mediante resección endoscópica. Las técnicas de resección usadas son la mucosectomía (EMR) y la disección submucosa endoscópica (ESD), las cuales se indican y consideran curativas en adenocarcinoma temprano de esófago intramucoso independientemente del tamaño, pudiendo extenderse el criterio curativo a las lesiones que invaden superficialmente la submucosa (<500um) y que miden <3cm, en ausencia de invasión linfovascular.
En Japón, la técnica de resección endoscópica recomendada es la ESD, por sus tasas más altas de resección en bloc y completa, especímenes más grandes que permiten mejor análisis histológico, y menor tasa de recurrencias, en comparación a la EMR, como se muestra en los resultados de la revisión sistemática realizada por la JGES (Japan Gastroenterological Endoscopy Society) en su mas reciente guía de resección endoscópica para cáncer esofágico. (1,2)
EMR | ESD | |
en bloc (%) | 50 | 96.4 |
R0 (%) | 39.7 | 81.9 |
Curative (%) | ? | ? |
Recurrence (%) | 12.4 | 2.5 |
- Ishihara R, Arima M, Lizuka T, et al (JGES). Endoscopic submucosal dissection/endoscopic mucosal resection guidelines for esophageal cancer. Dig Endoscopic 2020;32:452-493
- Ishihara R, Goda K and Oyama T.Endoscopic diagnosis and treatment of esophageal adenocarcinoma: introduction of Japan Esophageal Society classification of Barrett´s esophagus. J Gastroenterol 2019;54:1-9
- Sharma P, Shaheen N, Katzka D, et al. AGA clinical practice update on endoscopic treatment of Barrett´s esophagus with dysplasia and/or early cancer: Expert Review. Gastroenterol 2020;158:760-769
- Pimentel-Nunes P, Libanio D, Bastiaansen B, et al. Endoscopic submucosal dissection for superficial gastrointestinal lesions: European Society of Gastrointestinal Endoscopy (ESGE) Guideline - Update 2022. Endoscopy 2022; doi.org/10.1055/a-1811-7025
- Han C, Sun Y. Efficacy and safety of endoscopic submucosal dissection versus endoscopic mucosal resection for superficial esophageal carcinoma: a systematic review and meta-analysis. Dis Esophag 2020;00:1-14
- Terheggen G, Horn E-M, Vieth M, et al. A randomised trial of endoscopic submucosal dissection versus endoscopic mucosal resection for early Barrett´s neoplasia. Gut 2017;66:783-793
domingo, 27 de marzo de 2022
CÁNCER GÁSTRICO TEMPRANO DE TIPO INDIFERENCIADO: DISECCIÓN SUBMUCOSA ENDOSCÓPICA
CÁNCER GÁSTRICO TEMPRANO DE TIPO INDIFERENCIADO: DISECCIÓN SUBMUCOSA ENDOSCÓPICA
El tratamiento endoscópico del cáncer gástrico temprano de tipo indiferenciado no ha tenido el consenso necesario para considerarse el tratamiento estándar; sin embargo, recientes guías y estudios pueden cambiar esto. En nuestro grupo, después de casi 10 años de experiencia en disección submucosa endoscópica, y más de 200 resecciones realizadas por cáncer gástrico temprano, recién hace unos meses realizamos la primera en cáncer gástrico temprano de tipo indiferenciado. En la presente publicación les presentamos este caso y revisamos las más importantes publicaciones en relación a la evolución de la indicación de resección endoscópica en el cáncer gástrico temprano de tipo indiferenciado.
Caso clínico
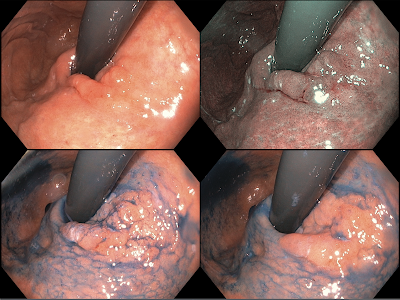
Varón de 56 años, con síntomas de reflujo, a quien se le realiza endoscopía detectando en incisura angularis de estómago, lesión deprimida de 16mm, sin úlcera, con predicción de invasión intramucosa (Fig. 1). Biopsia reveló adenocarcinoma indiferenciado subtipo anillo de sello. Tomografía de tórax y abdomen fueron negativas para metástasisganglionar o a distancia.
Con diagnóstico de Ud-EGC 0-IIc, UL0, tamaño <2cm, se indica y realiza ESD con sedoanalgesia, usando electrobisturí Dual knife de tipo regular (KD-650L), consiguiendo resección en bloque en 34 min. Espécimen extendido de 40 x 36mm. Los tiempos mas importantes de la ESD se presentan en la Fig. 2.
El análisis histopatológico describe lesión 0-IIc de 16mm, UL0, HM0, VM0, Ly0, V0, por lo que la resección endoscópica fue considerada curativa.
La endoscopía de vigilancia 6 meses después muestra área cicatricial en incisura angularis, sin evidencia de lesión residual o sincrónica (Fig 3). La tomografía de vigilancia también fue normal.
Discusión
La disección submucosa endoscópica (ESD, endoscopic submucosal dissection) se ha convertido en el tratamiento estándar del cáncer gástrico temprano (EGC, early gastric cancer) de tipo diferenciado con riesgo casi nulo de metástasis ganglionar. Sin embargo, el tratamiento endoscópico del EGC de tipo indiferenciado (Ud-EGC, undifferentiated), ha sido controversial, tanto por la menor tasa de resecciones completas y curativas, así como por los reportes de metástasis ganglionar aún en lesiones pequeñas y superficiales.
El estudio de Hirasawa et al., en especímenes quirúrgicos de gastrectomías con disección ganglionar por Ud-EGC, mostró que ninguna de 310 lesiones de cáncer indiferenciado intramucoso (pT1a), sin úlcera (UL0), tamaño <2cm y ausencia de compromiso linfovascular (Ly0, V0), se asoció con metástasis ganglionar (95% CI, 0-0.96%).1 Basado en este estudio, la más reciente guía de tratamiento de cáncer gástrico (5º edición) de la Japanese Gastric Cancer Association (JGCA), considera como indicación expandida de ESD, el Ud-EGC UL0, tamaño <2cm y clínicamente diagnosticado como intramucoso (cT1a).2 Tras la resección endoscópica en bloque y análisis patológico, cuando el Ud-EGC cumple estos criterios: pT1a, UL0, tamaño <2cm, HM0, VM0, Ly0, V0, la resección es clasificada como curabilidad endoscópica B (eCuraB). Esta guía puntualiza que el Ud-EGC con las características antes detalladas, no está incluido dentro de las indicaciones absolutas de ESD, ni en la categoría de curabilidad endoscópica A, por la falta de evidencia de resultados a largo plazo hasta el momento de publicación de la misma.
Recientemente, el estudio multicéntrico, prospectivo y confirmatorio del Japan Clinical Oncology Group (JCOG1009/1010) ha sido publicado.3 De 275 Ud-EGC con indicación expandida de ESD, 195 lograron resección curativa (71%) y en 79 la resección fue no curativa (73 recibieron gastrectomía adicional). En todo el grupo la valoración a 5 años mostró una sobrevida global de 99.3% (95% CI, 97.1-99.8%), y una sobrevida libre de recurrencia de 98.9% (95%CI, 96.5-99.6%). Es de destacar que de los 195 pacientes con resecciones curativas, ninguno tuvo en el seguimiento a 5 años, recurrencia local o a distancia, ni muertes registradas. Los excelentes resultados de este estudio en cuanto a eficacia y seguridad a largo plazo de la ESD en Ud-EGC con hasta entonces indicación expandida de ESD, ha motivado que la mas reciente guía de disección submucosa endoscópica para cáncer gástrico de la Japan Gastroenterological Endoscopy Society (2º edición),4 pase a considerar al Ud-EGD UL0, tamaño <2cm y cT1a, nueva indicación absoluta para ESD (nivel de evidencia B, grado de recomendación 1). Así mismo, si el análisis histopatológico confirma estos criterios: pT1a, UL0, tamaño <2cm, HM0, VM0, Ly0, V0, la resección es recategorizada como curabilidad endoscópica A (eCuraA). En un reciente meta-análisis en el que comparamos ESD vs cirugía incluyendo 7 estudios de cohorte y 2637 pacientes, no en contratos diferencia en la mortalidad global ajustada (aHR, 1.97; 95% CI, 0.85-4.53).5
Conclusión y recomendaciones
Creemos que recientes estudios y guías sustentan la indicación de ESD en Ud-EGC con características específicas y es muy probable que se constituya en su terapia estándar. Sin embargo, es muy importante el diagnóstico preciso en la evaluación preoperatoria, para satisfacer con claridad y sin dudas los criterios que sustentan la indicación de ESD. Además la ESD debe ser realizada teniendo ya experiencia avanzada con la técnica, se sugieren más de 50 ESD previas. El análisis histopatológico debe ser preciso, con cortes del espécimen cada 2mm para estar seguro de los detalles de invasión en profundidad y excluir compromiso linfovascular. Finalmente, la vigilancia cada 6 meses con endoscopía y tomografía son muy importantes.
Bibliografía
1. Hirasawa T, Gotoda T, Miyata S, et al. Incidence of lymph node metastasis and the feasibility of endoscopic resection for undifferentiated-type early gastric cancer. Gastric Cancer 2009;12:148-152
2. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer 2021;24:1-21
3. Takizawa K, Ono H, Hasuike N, et al. A nonrandomized, single-arm confirmatory trial of expanded endoscopic submucosal dissection indication for undifferentiated early gastric cancer: Japan Clinical Oncology Group study (JCOG1009/1010). Gastric cancer 2021;24:479-491
4. Ono H, Yao K, Fujishiro M, et al. Guidelines for endoscopic submucosal dissection and endoscopic mucosal resection for early gastric cancer (second edition). Digestive Endoscopy 2021;33:4-20
5. Benites H, Palacios F, Carlin A, et al. Endoscopic submucosal dissection versus surgery for patients with undifferentiated early gastric cancer. Rev Esp Enferm Dig 2022. doi: 10.17235/reed.2022.8564/2021.