BIOPSIA
INTRAQUÍSTICA CON MICROPINZA DE NEOPLASIA MUCINOSA PAPILAR INTRADUCTAL EN
CABEZA DE PÁNCREAS (CON VIDEO)
Dr. Bruno Li
Salvatierra
En esta
oportunidad presentamos el caso de un paciente varón de 65 años que por un
cuadro de dolor abdominal agudo fue evaluado en otro centro, en donde los
estudios más relevantes mostraron elevación patrón laboratorial colestasico,
por lo cual se le realizó colangio-RMN encontrándose lesión quística en cabeza
de páncreas.
Al ser evaluado por nosotros el paciente se encontraba asintomático, se actualizaron estudios de laboratorio: Hb 13.9 g/dl, bilirrubina total 0.31, bilirrubina directa 0.25 mg/dl, fosfatasa alcalina 536 U/L, TGP 567 U/L, TGO 317 U/L, CA 19.9 11 U/ml. Revisando las imágenes realizadas (figura 1), identificamos imagen quística de 3 cms. en cabeza de páncreas, la cual se comunicaba con el conducto pancreático principal el cual se encontraba dilatado hasta 6 mm, además dentro de la lesión quística se visualizó una imagen sugerente de nódulo mural pero al no mostrar realce esto no era concluyente, todos estos hallazgos compatibles con IPMN mixto con características preocupantes, sin embargo este paciente no presentaba claros estigmas de alto riesgo como para ser considerado candidato quirúrgico directo. Cabe mencionar, que no desestimamos que el paciente presentaba un perfil hepático colestasico y vía biliar ectásica en colangio-RMN, no obstante el paciente no presentaba ictericia obstructiva. Es por este motivo que se optó por la realización de ecoendoscopia, y con ello definir conducta terapéutica.
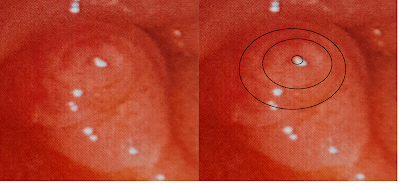
En la ecoendoscopia (Figura 2 y 3) se identificó en cabeza de páncreas lesión anecogénica (quística) de 37 mm, la cual se comunicaba claramente con el conducto pancreático principal el cual se encontraba dilatado hasta 9 mm (en su segmento más cercano a la lesión). Dentro de esta lesión quística se identificó imagen hiperecogénica (respecto a tejidos blandos adyacentes) dependiente de su pared, de 12 x 13 mm, de bordes más o menos regulares, doppler (+), todas estas características muy sugerentes de nódulo mural más que bola de mucina, sin embargo llamo la atención durante barrido ultrasonográfico que este aparente nódulo mostraba algo de sombra acústica posterior, esto nos obligaba a utilizar algún método adicional para confirmar que se trataba de un verdadero nódulo mural.
Figura 3. Ecoendoscopia: Nódulo mural y comunicación con conducto pancreático principal dilatado (9 mm)
Se decidió realizar punción aspiración con aguja fina tipo
FNA de 19 g y biopsia con micropinza (figura 4) de nódulo mural y pared adyacente (5 y 6,
video 1). Se obtuvieron muestras tisulares pequeñas
y fluido para estudio de
CEA: 17 ng/ml y glucosa: 47 mg/dl (compatible con lesión mucinosa).
Video 1. Biopsia de nódulo mural en IPMN con micropinza.
En la histología se encontraron hallazgos compatibles con neoplasia mucinosa papilar intraductal tipo intestinal tipo intestinal (figura 7), lo cual confirmó que se trataba de un nódulo mural dentro una IPMN. Con los hallazgos anteriormente descritos se decidió referir a paciente a cirugía.
Figura 7. Hallazgos histológicos compatibles con IPMN tipo intestinal.
Las neoplasias mucinosas papilares intraductales (IPMN) son neoplasias epiteliales que crecen dentro del sistema de conductos del páncreas [1,2]. Las células neoplásicas suelen formar papilas y, a veces, producen grandes cantidades de mucina. Esta mucina y/o tejido tumoral papilar pueden distender localmente el sistema de conductos, produciendo así una lesión "quística".
Desde el punto de vista anatómico las IPMN se clasifican en 3 tipos, cada cual con un riesgo de malignidad ampliamente estudiado y conocido [3]:
▪
IPMN de ducto principal: Que
corresponde a una dilatación segmentaria o difusa del CPP > 5 mm, sin otras
causas de obstrucción, con un riesgo de malignidad del 62.2%.
▪
IPMN de rama lateral: Que
corresponde a un quiste pancreático > 5 mm que se comunica con el conducto
pancreático principal, con un riesgo de malignidad del 24.4%.
▪
IPMN mixto: Que cumple con
criterios de los dos anteriores, con un riesgo de malignidad del 57.6%
Por
lo tanto, las IPMN son lesiones precursoras y, si se dejan sin tratamiento, una
proporción de ellas progresaran a un adenocarcinoma invasivo. Así como los
adenomas del colon pueden ser tratados antes de que se desarrolle un cáncer
invasivo, las IPMN también podrían ser tratadas antes de que progresen a un
cáncer pancreático invasivo [4]. El desafío es que, debido a la morbilidad asociada
con la cirugía pancreática (la cual es mucho menor en cirujanos expertos en páncreas),
no todas las IPMN deberían operarse [5]. Por ello se debe sopesar
cuidadosamente los riesgos de la cirugía con los beneficios potenciales de la
misma en cada paciente.
Para ello el consenso en el consenso de Fukuoka [3], se establecieron los siguientes criterios:
- Estigmas de alto riesgo:
o En IPMN ducto principal o mixto: conducto pancreático principal > 10 mm o presencia de ictericia obstructiva.
o En IPMN de rama lateral: Componente sólido con realce en imágenes.
- Características preocupantes:
o
En IPMN ducto principal o mixto: conducto pancreático
principal entre 5 y 9 mm.
o En IPMN de rama lateral: lesión ≥ 3 cms, nódulo mural (sin realce), engrosamiento/realce paredes.
En
pacientes con Estigmas de Alto Riesgo
está indicada la cirugía si el paciente es un buen candidato quirúrgico, en
pacientes con Características
Preocupantes está indicada la realización de ecoendoscopia para valorar la
presencia cambios más sutiles no visualizados en RMN (presencia de masa sólida,
confirmación/identificación de nódulo mural, engrosamiento de paredes o septos,
compromiso del conducto pancreático principal) y con ello definir quienes
deberían ir a cirugía.
Antes de
la realización de la ecoendoscopia, nuestro paciente no mostraba estigmas de
alto riesgo evidentes, sin embargo, presentaba características preocupantes
(lesión de 3 cms, conducto pancreático principal de 6 mm, sin evidencia clara de
presencia de nódulo mural con realce), es por este motivo que se decidió la
realización de ecoendoscopia (USE).
En la USE desde el punto de vista
morfológico se encontraron varios hallazgos que llamaron la atención, el
primero de ellos la presencia de una imagen compatible con nódulo mural.
La identificación de un nódulo mural
tiene una precisión diagnóstica de hasta el 83% para detectar quistes mucinosos
con alto riesgo de malignidad [6]. Sin embargo, es conocido que la mayoría de
lesiones ecogénicas dentro de quistes mucinosos son bolas de mucina, lo cual
puede limitar la precisión diagnóstica de este estudio.
Por ello, existen múltiples reportes en donde se describen las diferencias ultrasonográficas entre un nódulo mural y una bola de mucina [7]:
- Nódulo mural: isoecogénico o hiperecogénico en comparación a tejidos
blandos adyacentes, no tienen bordes lisos y no tiene un halo hiperecogénico
periférico.
- Bola de
mucina: hipoecogénica en comparación con el tejido blando adyacente, de bordes
lisos, tiene un halo hiperecogénico periférico.
A pesar de ello, esta reportado [7] que considerando estas características la precisión diagnóstica no supera el 79 %, con moderada concordancia interobservador (coeficiente Kappa 0.44).
Cuando se realiza punción aspiración
con aguja fina, se ha evidenciado que solo identificándose citología de alto
riesgo (displasia de alto grado, carcinoma invasivo) se alcanza una
especificidad del 100% y sensibilidad del 50% para detectar lesiones mucinosas
de alto riesgo, hallazgos citológicos distintos a estos tienen un rendimiento
diagnóstico muy limitado [6].
Por lo cual, en la actualidad en el
mundo se cuenta con tecnología como CE-EUS (ecoendoscopia realzada con
contraste) o la micropinza (through the needle) Moray, las cuales nos permiten
diferenciar con mayor certeza si se trata de un verdadero nódulo mural.
La CE- EUS ha demostrado mejorar la
precisión diagnóstica (hasta 98%) para diagnosticar nódulos murales [8],
teniendo la ventaja de ser menos invasiva pues no se requiere la realización de
punción con aguja, y aunque contamos con el software para realizar esta
técnica, en nuestro país aún no contamos con el medio de contraste (Sonovue)
necesario para realizar la misma.
Por otro lado, la micropinza (through
the needle) Moray es una adición reciente en nuestro medio al arsenal de ecoendoscopia diagnóstica.
Esta micropinza es de un solo uso, mide 230 cm de largo, con un diámetro exterior
<1 mm, por lo cual puede pasar a través de la luz de una aguja de EUS-FNA de
calibre 19 g. Esto permite el muestreo histológico de lesiones quísticas
pancreáticas mediante la obtención de biopsias de la pared y/o nódulos murales
dentro del quiste, que pueden mejorar la precisión del diagnóstico [9].
Un estudio
reciente [10] demostró que, en la capacidad para diagnosticar quistes con alto
riesgo de malignidad, el rendimiento fue: micropinza (71.5%) versus citología
(54.7%). Además, la concordancia entre la patología quirúrgica y la micropinza
fue del 85 %, comparado con la citología que fue del 15%. En este estudio el
rendimiento de adquisición tisular de la micropinza fue del 90%.
En nuestro paciente al encontrarse en
la USE la presencia de un aparente nódulo mural, decidimos la realización de
microbiopsias del mismo y de su pared adyacente en búsqueda de confirmación
histológica de IPMN y displasia.
Se obtuvieron con éxito muestras
tisulares, las cuales al estudio histopatológico resultaron ser
compatibles con IPMN tipo intestinal, que por definición es displasia de grado
intermedio y se asocia principalmente a IPMN de ducto principal (73% de los
casos) [11], el cual se correlaciona con mayor frecuencia de malignidad, motivo por el cual paciente fue derivado a cirugía de páncreas.
Video adjunto: https://youtu.be/s0XLlcWE4os
* Nuestro agradecimiento al Dr. Franco Doimi García por su contribución en el estudio histopatológico de este caso.
REFERENCIAS BIBLIOGRÁFICAS:
1. Bosman F, Carneiro F, Hruban RH, Theise N (eds). WHO classifi cation of tumours of the digestive system. 4th ed. Lyon: IARC; 2010.
2. Hruban RH, Takaori K, Klimstra DS, et al. An illustrated consensus on the classifi cation of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. Am J Surg Pathol. 2004;28(8):977–87.
3. Tanaka M, Fernandez-Del Castillo C, Adsay V, et al. International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas. Pancreatology. 2012;12(3):183–97.
4. Lennon AM, Wolfgang CL, Canto MI, et al. The early detection of pancreatic cancer: what will it take to diagnose and treat curable pancreatic neoplasia? Cancer Res. 2014;74(13):3381–
5. Hruban RH, Schulick RD. Is surgery required for patients with intraductal papillary mucinous neoplasms without mural nodules? Nat Clin Pract Gastroenterol Hepatol. 2008;5(11):598–9.
6. Scourtas A, Dudley J, Brugge W et al. Preoperative Characteristics and Cytological Features of 136 Histologically Confirmed Pancreatic Mucinous Cystic Neoplasms. Cancer Cytopathology. 2017; 125 (3): 169-177
7. Zhong N, Zhang L, Takahashi N et al. Histologic and imaging features of mural nodules in mucinous pancreatic cysts. Clinical gastroenterology and Hepatology 2012; 10:192–198
8. Harima H, Kaino S, Shinoda S et al. Differential diagnosis of benign and malignant branch duct intraductal papillary mucinous neoplasm using contrast enhanced endoscopic ultrasonography. World J Gastroenterol 2015 May 28; 21(20): 6252-6260
9. Mittal C, Obuch J, Hammad H et al. Technical feasibility, diagnostic yield, and safety of microforceps biopsies during EUS evaluation of pancreatic cystic lesions. Gastrointest Endosc 2018; 87: 1263–1269
10. Basar O, Yuksel O, Yang DJ et al. Feasibility and safety of microforceps biopsy in the diagnosis of pancreatic cysts. Gastrointest Endosc 2018; 88: 79–86
11.
Del Chiaro, Marco, Haas, Stephan L, Schulick, Richard D. Cystic Tumors of the
Pancreas: Diagnosis and Treatment. 2016