DEFINICIONES
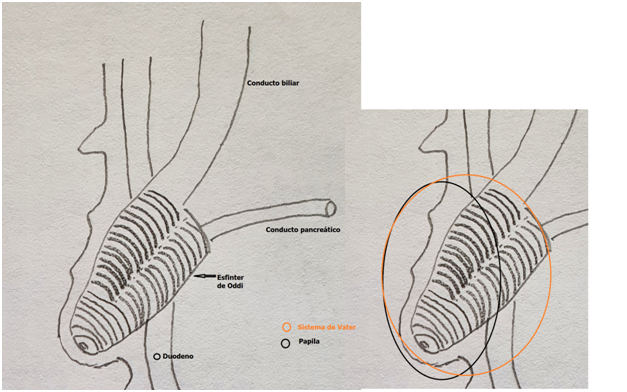
El Sistema
de Vater: son las estructuras que se inician desde la súbita disminución del
conducto biliar distal, que puede ocurrir generalmente antes de la llegada a la
pared del duodeno o a veces ya dentro, hasta el orificio de la papila
mayor. El Sistema de Vater incluye a la
papila, la ampolla (cuando está presente), y las porciones distales de la vía
biliar y pancreática con sus respectivas capas musculares (el esfínter de Oddi)
y fibróticas.
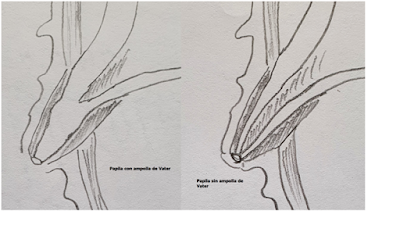
La Ampolla
de Vater: es la unión de los segmentos terminales del conducto biliar y
pancreático, formando en muchos casos un segmento dilatado.
La Papila de Vater: es la pequeña dilatación en la mucosa del duodeno que aloja los segmentos distales de los conductos biliares y pancreáticos, ya sean juntos formando la ampolla de Vater o por separado (1).
Fig 1: Esquema del sistema de Vater y la papila de Vater. El sistema de Vater también incluye las estructuras que se forman antes de llegar a la pared del duodeno
Fig 2: Esquema de la papila de Vater con ampolla de Vater y sin ella. Puede o no existir la ampolla de Vater.
En el 75%
de los casos la papila se ubica en la mitad de la segunda porción del duodeno y
en 25% de los casos se encuentra más distal, en la porción horizontal del
duodeno. Rara vez la papila se puede
encontrar en el bulbo duodenal.
Cuando la
papila se encuentra en la segunda porción, la vía pancreática se encuentra inferior y
anterior a la vía biliar y cuando está en la porción horizontal el ducto
pancreático es vertical y paralelo al
borde izquierdo del conducto biliar común (2).
Estas diferentes disposiciones de la vía biliar y pancreática también se
refleja en la posición que tienen en el poro de la papila, hecho a tener en cuenta a la hora de canular.
Fig 4: Comparación de la posición del conducto biliar y del conducto pancreático cuando la papila se encuentra en segunda porción (A) y cuando se encuentra en la porción horizontal (B). Tomado de Avisse (2).
Fig 5: El eje del conducto biliar cuando la papila se encuentra en porción horizontal es casi vertical y el conducto pancreático corre paralelo a este. Tomado de Avisse (2).
CONFLUENCIA DEL CONDUCTO BILIAR Y PANCREÁTICO
Los conductos biliar y pancreático llegan a la papila como un conducto común en 60% de los casos, como un doble cañón en un 38% y como dos canales separados en 2% de los casos. Esto también se traduce en el poro de la papila (2)
Flati
clasifica la confluencia colédoco-Wirsung en 5 tipos. 1y2) Tipo Y, que puede ser con un conducto
común corto (1.5 a 10 mm) o con conducto común largo (mayor de 10 mm). 3) Tipo
V, canal común virtualmente ausente. 4) Tipo U, orificios separados que llegan
a la misma papila. 5) Tipo II, el colédoco llega a la papila mayor y el conducto
biliar principal a la papila menor (Páncreas divisum) (3).
TIPOS DE PORO
Los tipos
más frecuentes de poros son el de tipo cebolla (1/3), nodular (1/3), velloso y
plano (los dos últimos 1/3). Los tipos
de poro separado y vertical son poco frecuentes (5).
Poro tipo Cebolla
En el tipo
cebolla los conductos biliar y pancreático se encuentran separados por un
pequeño septum en un 90% de los casos (Tipo V de Flati). El ingreso a la vía biliar se encuentra en el
centro de la estructura concéntrica, la parte superior de la parte que
sobresale ligeramente es la abertura del conducto biliar (5).
Fig 7. Papila tipo cebolla. Modificado de Inomata (5).
Para
canular este tipo de poro es necesario tomar en cuenta el septum central que
puede desplazarse por la cánula o esfinterótomo y puede obstruir el
ingreso. Para evitar este problema es
necesario empujar el borde del labio superior del poro, luego rectificar e ingresar.
Fig 8. gráfico para ilustrar el problema del tabique central al momento de canular. Tomado de Inomata.
Fig 9. gráfica para ilustrar como canular una papila con confluencia en V. Tomado de Inomata.
Poro tipo Nodular
En el tipo
nodular se observa un pequeño nódulo en el ingreso al orificio del conducto biliar,
el cual tiene que ser desplazado para lograr canularlo.
Fig 10. Poro tipo nodular y la forma como canularlo. Tomado de Inomata.
Poros tipo Velloso y plano.
Los poros tipo velloso y plano se asocian a una confluencia en Y, que puede ser corto o largo. El problema de la confluencia en Y larga es
que el conducto común se tiende a corrugar en algunos casos dificultando la
canulación profunda. A veces es necesario inyectar un poco el contraste para
poder dirigir la guía. En el tipo
plano, el orificio de ingreso a menudo es de pequeño diámetro lo que dificulta
la canulación inicial y se requiere de una cánula delgada o ayudarse de la guía
para fijar la posición para poder “embocar”.
Fig 11 Poro tipo velloso. Modificado de Inomata
A nivel del ostium del conducto biliar se forman como vellosidades papilares asociadas a glándulas mucosas. En algunos casos estas vellosidades salen fuera del ostium dando ese aspecto velloso (6).
Papilas con poros tipo longitudinal y doble poro
Estos dos tipos de papila son poco frecuentes, sobre todo el de doble poro. En las papilas con poro longitudinal la canulación se realiza en el borde superior, siempre hacia las 11. En el de doble poro la canulación del conducto biliar es fácil, porque no es necesario identificar el tipo de papila, pero si tienes que canular el conducto pancreático es imporrtante que notes donde se encuentra su boca.
Fig 14. Papila con doble poro. Modificado de Inomata.
FORMA DE LA PAPILA
La forma de
la papila generalmente es cilíndrica-cónica en un 77.8% de los casos, luego
hemisférica en 14.3% de los casos y plana en 8.1% de los casos (3).
Fig 15. A) Papila hemisférica. B) Papila cilindrica con protusión. C) Papila plana. Tomado de Horiuchi y Haraldsson (7 y 8).
Algunas
papilas de forma cilíndrica o cónica tienen una protrusión larga. En estas papilas el conducto biliar
generalmente corre por el domo siguiendo el eje longitudinal de la papila para
luego cambiar de su curso para atravesar la pared del duodeno. Por eso cuando uno se enfrenta a una papila
cónica larga tiene que ir cambiando el eje de la canulación, horizontal en un
inicio, se corruga un poco la papila y luego vertical.
Las papilas yuxtadiverticulares serán tratadas en el futuro.
Hasta el próximo Post. Por favor si te pareció interesante compártelo.
Saludos, Dr Max Yoza
Bibliografía
1) Dowdy, Gerald S.,
George W. Waldron, and Wilson G. Brown. “Surgical Anatomy of the Pancreatobiliary
Ductal System: Observations.” Archives of Surgery 84, no. 2 (February 1,
1962): 229–46. https://doi.org/10.1001/archsurg.1962.01300200077006.
2) Avisse, C., J. B. Flament, and J. F. Delattre.
“Ampulla of Vater. Anatomic, Embryologic, and Surgical Aspects.” The
Surgical Clinics of North America 80, no. 1 (February 2000): 201–12. https://doi.org/10.1016/s0039-6109(05)70402-3.
3) Flati, G.,
D. Flati, B. Porowska, T. Ventura, M. Catarci, and M. Carboni. “Surgical Anatomy of the Papilla of
Vater and Biliopancreatic Ducts.” The American Surgeon 60, no. 9
(September 1994): 712–18.
4) Komorowski,
Richard A. “Anatomy and Histopathology of the Human Sphincter of Oddi.” Gastrointestinal
Endoscopy Clinics of North America, The Sphincter of Oddi Primer for the
Pancreaticobiliary Endoscopist, 3, no. 1 (January 1, 1993): 1–11. https://doi.org/10.1016/S1052-5157(18)30590-7.
5) Inomata Masaaki,
Saito Shinji, Shibata Sho, Endo Masaki, Orii Seishi. PCRE.
Canal biliar, canulación y contraste. Manual de tratamiento endoscópico para
residentes. Endoscopia Digestiva.
Volumen 18, Número 5, May 2006.
6) Frierson, H. F. “The Gross Anatomy and Histology of
the Gallbladder, Extrahepatic Bile Ducts, Vaterian System, and Minor Papilla.” The
American Journal of Surgical Pathology 13, no. 2 (February 1989): 146–62. https://doi.org/10.1097/00000478-198902000-00008.
7)
Horiuchi, Akira, Yoshiko Nakayama, Masashi Kajiyama, and Naoki Tanaka. “Effect of
Precut Sphincterotomy on Biliary Cannulation Based on the Characteristics of
the Major Duodenal Papilla.” Clinical Gastroenterology and Hepatology 5,
no. 9 (September 1, 2007): 1113–18. https://doi.org/10.1016/j.cgh.2007.05.014.
8)Haraldsson, E, L Lundell, F Swahn, L Enochsson, JM
Löhr, and U Arnelo. “Endoscopic Classification of the Papilla of Vater. Results
of an Inter- and Intraobserver Agreement Study.” United European
Gastroenterology Journal 5, no. 4 (June 2017): 504–10. https://doi.org/10.1177/2050640616674837.